Elektrokimya Özellikleri ve Faydaları Nelerdir?
Elektrokimya, elektrik ve kimyanın etkileşimini inceleyen bir bilim dalıdır. Bu alan, enerji depolama, korozyon kontrolü ve analitik uygulamalar gibi çeşitli uygulamalara sahiptir. Elektrokimyanın sağladığı çevre dostu enerji üretimi ve yüksek verimlilik gibi faydalar, modern teknolojilerin gelişiminde kritik bir rol oynamaktadır.
Elektrokimya, elektrik ve kimyanın kesişim noktasında yer alan bir bilim dalıdır. Bu alan, kimyasal reaksiyonların elektriksel süreçlerle nasıl etkileşime girdiğini ve bu etkileşimin çeşitli uygulamalarını incelemektedir. Elektrokimyada temel olarak iki ana süreç bulunmaktadır: elektroliz ve galvanik hücreler. Bu makalede, elektrokimenin özellikleri, uygulama alanları ve sağladığı faydalar detaylı bir şekilde ele alınacaktır. Elektrokimyanın Temel Özellikleri Elektrokimyanın çeşitli özellikleri, bu bilimin uygulama alanlarını genişleten önemli unsurlardır. Bu özellikler aşağıdaki gibi sıralanabilir:
Elektrokimyanın Uygulama Alanları Elektrokimya, birçok endüstri ve bilim dalında geniş bir uygulama yelpazesine sahiptir. Bu uygulama alanları arasında şunlar yer almaktadır:
Elektrokimyanın Faydaları Elektrokimya, hem endüstriyel hem de çevresel alanlarda birçok fayda sağlamaktadır. Bu faydalar arasında şunlar bulunmaktadır:
Sonuç Elektrokimya, modern bilimin önemli bir dalı olarak birçok alanda geniş uygulama olanakları sunmaktadır. Enerji üretimi, depolama, korozyon kontrolü ve analitik uygulamalar gibi çeşitli alanlarda sağladığı faydalarla, elektrokimya hem çevresel hem de ekonomik açıdan önemli bir rol oynamaktadır. Bu bağlamda, elektrokimya alanındaki gelişmelerin ve araştırmaların devam etmesi, gelecekte daha sürdürülebilir ve verimli teknolojilerin ortaya çıkmasına katkı sağlayacaktır. |
.webp)








.webp)
.webp)








.webp)


.webp)
.webp)

.webp)










Elektrokimya konusunda, bir voltaj uygulandığında kimyasal reaksiyon meydana gelmesini sağlayan mekanizma nasıl çalışır? Bu reaksiyonlar kendiliğinden oluşan kimyasal etkileşimlerle kıyaslandığında, ne tür enerji dönüşümleri söz konusu olur? Metallerin aktiflik sıralamasında, yükseltgenme potansiyeli yüksek olanların daha aktif olduğunu belirtiyorsunuz. Peki, bir metalin elektron verme yatkınlığını artıran faktörler nelerdir? Bu durum, pratikte nasıl gözlemlenir? Anot ve katot reaksiyonlarının pil sistemindeki işleyişi hakkında daha ayrıntılı bilgi verebilir misiniz? Pil potansiyelinin artması ve azalması durumunda pilin çalışma performansını nasıl etkiler? Elektroliz olayında, birden fazla cins katyon ve anyon bulunması durumunda indirgenme ve yükseltgenme sıralaması nasıl belirlenir? Elektroliz devresinde anot ve katotta toplanacak madde miktarının, devreden geçen elektrik akımı ile doğru orantılı olması ne anlama gelir? Elektrokimyanın uygulama alanlarından bahsetmişsiniz. Örneğin, piller ve akümülatörlerin elektrik enerjisini kimyasal enerji olarak depolaması sürecinde hangi reaksiyonlar gerçekleşir? Bu dönüşümün verimliliği nasıl sağlanır?
Merhaba Abdüsselam bey,
Elektrokimya konusundaki sorularınıza yanıt vermek isterim.
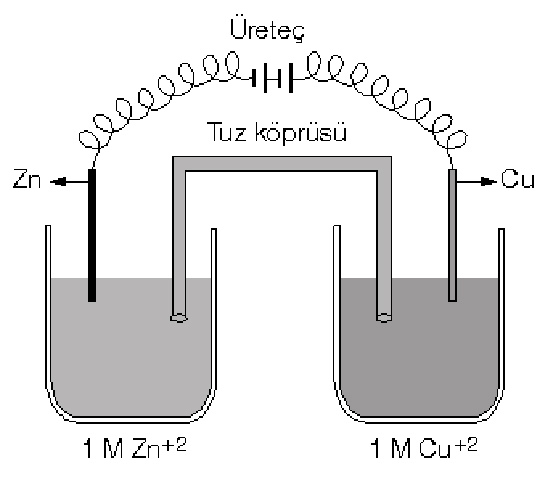
Kimyasal Reaksiyon Mekanizması: Elektrokimyasal hücrelerde, bir voltaj uygulandığında kimyasal reaksiyonlar, elektronların anottan katoda hareketi ile gerçekleşir. Bu süreç, kimyasal enerjiyi elektrik enerjisine dönüştüren pil sistemlerinde tersine çevrilebilir. Kendiliğinden oluşan reaksiyonlarla kıyaslandığında, elektrokimyasal reaksiyonlar dışarıdan enerji gerektirir ve bu enerji, elektrik akımı şeklinde sağlanır.
Metallerin Aktiflik Sıralaması: Bir metalin elektron verme yatkınlığını artıran faktörler arasında metalin atomik yapısı, elektron dizilimi ve çevresel koşullar yer alır. Pratikte, daha aktif metaller daha kolay oksitlenir ve bu da onların daha hızlı korozyona uğramasına veya elektroliz sırasında daha kolay çözünmesine neden olur.
Anot ve Katot Reaksiyonları: Pil sistemlerinde anot oksidasyon, katot ise indirgenme reaksiyonlarının gerçekleştiği yerlerdir. Pil potansiyeli arttığında, pilin ürettiği elektrik enerjisi de artar ve bu, pilin performansını iyileştirir. Aksi durumda, pil potansiyeli azaldığında, enerji üretimi düşer ve pilin performansı zayıflar.
Elektroliz Olayı: Elektroliz sırasında, katyonlar katotta indirgenir, anyonlar ise anotta yükseltgenir. Hangi iyonların indirgenip yükseltgeneceği, elektrot potansiyellerine bağlıdır. Devreden geçen elektrik akımı ile doğru orantılı olarak toplanan madde miktarı, Faraday’ın elektroliz yasalarına göre belirlenir. Bu, belirli bir akım miktarının belirli bir madde miktarını elektrolizle ayıracağını ifade eder.
Elektrokimyanın Uygulama Alanları: Piller ve akümülatörlerde, elektrik enerjisi kimyasal enerji olarak depolanır. Bu süreçte, anot ve katotta gerçekleşen reaksiyonlar sayesinde enerji dönüşümü sağlanır. Bu dönüşümün verimliliği, elektrot malzemeleri ve hücre tasarımı gibi faktörlerle optimize edilir.
Umarım bu bilgiler sorularınıza yanıt olmuştur. Başka sorularınız olursa memnuniyetle yardımcı olurum.
Saygılar,